医疗注册
提供医疗注册的流程,代为申请注册,提供检测报告,ISO13485体系认证培训,相关的文字图片资料也来自网络。仅供学习参考使用。
医疗注册
提供医疗注册的流程,代为申请注册,提供检测报告,ISO13485体系认证培训,相关的文字图片资料也来自网络。仅供学习参考使用。
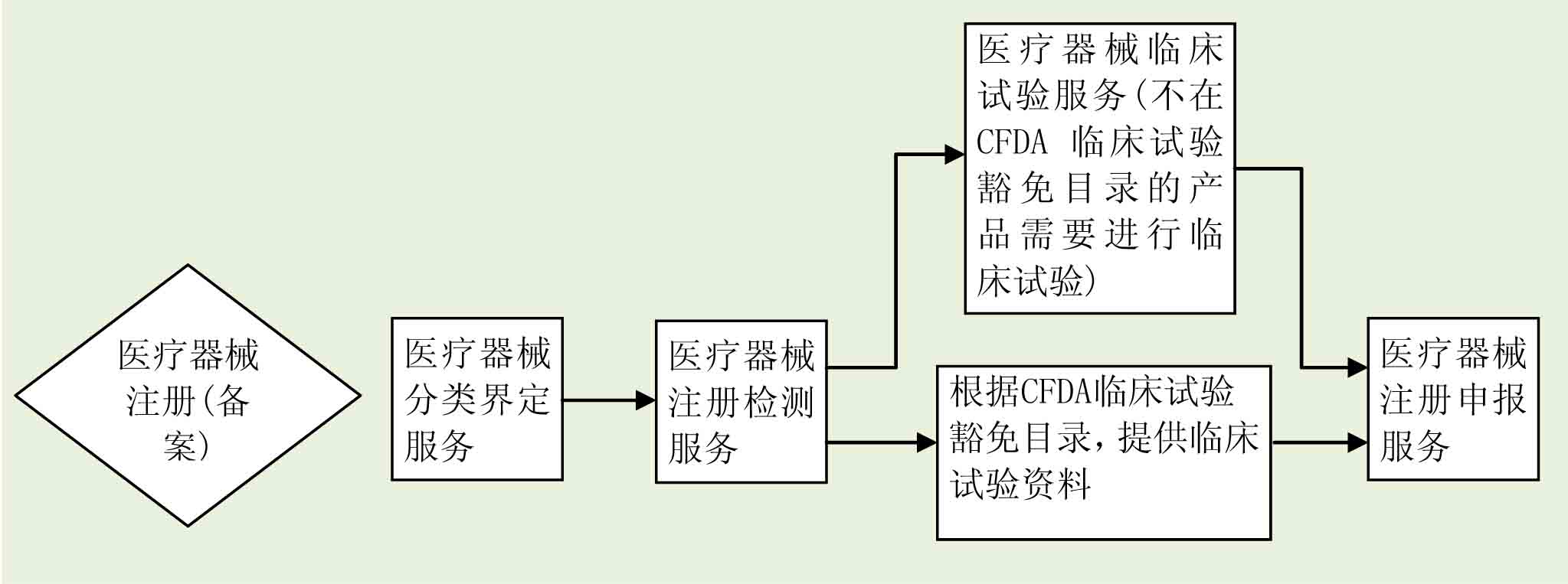
医疗器械分类界定服务
1. 医疗器械分类管理
中国对医疗器械产品按照风险程序将其分为三类(即I类、II类和III类医疗器械),实行分类管理,不同类别的医疗器械产品,其注册、备案、许可程序及要求也不一样, 因此在医疗器械注册及相关许可申请之前确定产品分类是非常关键的。
I类医疗器械:风险程度低,实行常规管理可以保证其安全、有效的医疗器械。
II类医疗器械:具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
III类医疗器械:具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
医疗器械分类的确定需要考虑产品的预期用途、结构特征和使用方法,并依据医疗器械分类规则、分类目录及现有产品标准等进行判定,必要时也可以申请分类界定申请,食品药品监督管理部门将组织专家对提交申请的产品进行分析并归类。
2. 分类界定服务
医疗器械技术专家将通过对产品的深入分析,结合现行医疗器械分类相关法规及规范,为企业提供分类界定服务:
|
服务内容 |
服务方式 |
|
|
产品分析 |
1. 产品中文名称、预期用途、结构特征、使用方法等的法规符合性审核 2. 确认是否属于医疗器械管理 3. 确认是否满足医疗器械注册要求 4. 确认是否满足中国上市要求 5. 确认法规符合性要求 |
电话或邮件咨询、培训,并提供《法规符合性审核报告》 |
|
分类确认 |
明确医疗器械的管理类别及注册要求 |
《医疗器械分类确认报告》 |
|
分类界定申请(可选) |
向CFDA申请分类界定(通过“医疗器械分类界定信息系统在线提交)——适用于新产品 |
《医疗器械分类界定报告》 |
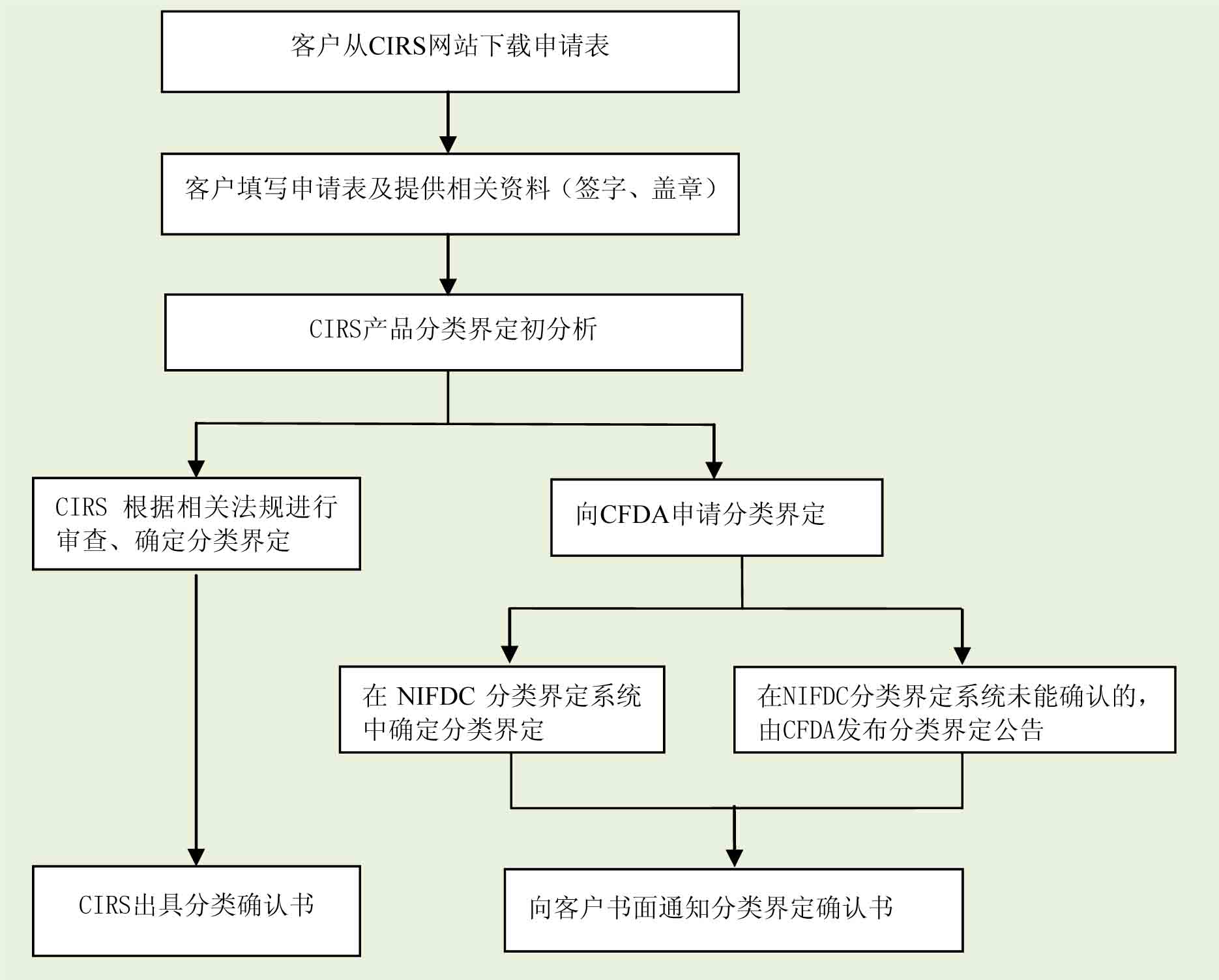
3. 服务流程
下载“医疗器械分类确认申请表”(点击下载)
根据要求填写申请表并及时反馈
医疗器械技术专家根据企业提供的产品信息进行预分析,并向企业确认分类界定需求
根据企业提供的产品信息,并根据相关法规进行审查,最终确定产品分类,向企业发送书面的“医疗器械分类报告”
向CFDA申请产品分类界定,并跟踪分类界定结果,及时向企业发送书面的“医疗器械分类界定报告”
医疗器械注册检测服务
1. 注册检测范围
注册检测是在CFDA认可的检测机构,按照企业自行编制的产品技术要求(产品注册标准)对产品样品的性能指标及随附的产品说明书、标签等进行符合性核查的一个过程。
对于第II、III类医疗器械产品,注册前必须要在经CFDA认可的检测机构取得检测报告,并将检测报告作为注册申请的主要资料之一提交给CFDA进行审查;对于I类医疗器械,备案时可提交企业自测报告或第三方测试报告。
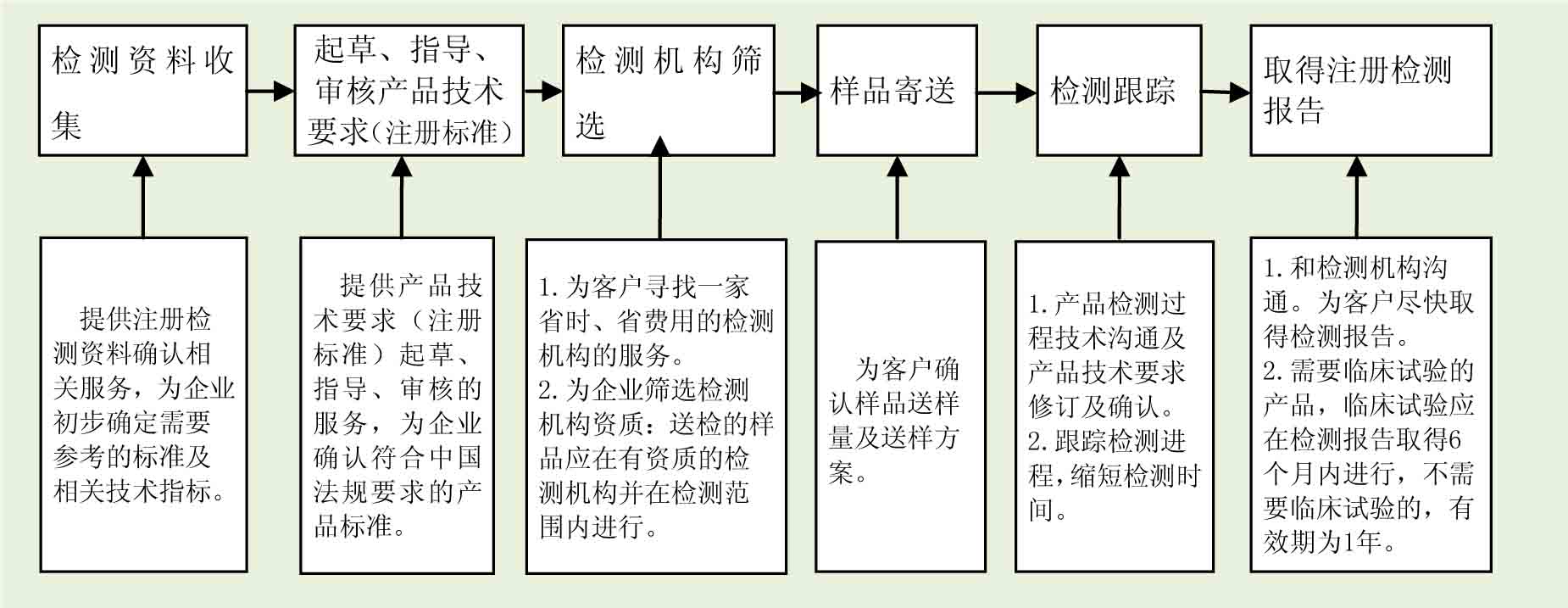
2. 注册检测服务
测试方案及计划的制订,测试项目的确定及豁免项目的申请
协助联系有资质的实验室并协调测试进程
协助起草、制定、审核产品技术要求(注册标准)
协助确定样品量及样品送检过程服务
注册检测进度跟踪、检测过程技术沟通、快速完成注册检测并获得完整报告
3.服务流程
4. 常规检测项目
|
医疗器械分类 检测项目 |
无源医疗器械 |
有源医疗器械 |
体外诊断试剂 |
常规检测项目 |
|
理化性能 |
● |
● |
● |
外观、尺寸、力学性能(高分子材料)、比重、透光度(生物材料)、酸碱度、重金属、炙灼残渣、紫外吸光度、易氧化物、含水量(可吸收材料类)、环氧乙烷残留(EO灭菌的产品)、特性粘度(生物制品、高分子材料类) |
|
生物学性能 |
● |
● |
/ |
无菌、内毒素、细胞毒性试验、致敏试验、亚慢性毒性试验、皮内刺激试验、急性全身毒性试验、遗传毒性试验、溶血试验、植入试验(根据产品使用周期确认) 热源试验 |
|
电气安全 |
/ |
● |
/ |
GB 9706.1电气安全通用要求 GB 9706 电气安全专用要求 YY 0505 电气安全专用要求 并列标准 电磁兼容 GB 4793.1 测试、控制和实验室用电气安全专用要求 并列标准 GB/T 14710 医用电气环境要求及试验方法 |
|
方法学测试 |
/ |
/ |
● |
溯源性、测量系统的线性、准确度、分析特异性、精密度、检测限/定量限、稳定性 |
备注:
无源医疗器械根据不同材料组成、预期用途及接触时间,其测试项目也不同。
生物学测试根据ISO 10993.1 /GB/T16886.1的要求进行选择。
有源非诊断类器械执行相应标准:GB 9706.1电气安全通用要求; GB 9706 电气安全专用要求;YY 0505 电气安全专用要求; GB/T 14710 医用电气环境要求及试验方法。
诊断试剂及仪器类执行GB 4793.1测试、控制和实验室用电气安全专用要求; YY 0505 电气安全专用要求;GB/T 14710 医用电气环境要求及试验方法。
医疗器械注册申报服务
1.法规依据
根据《医疗器械监督管理条例》(国务院令第650号)的规定,对医疗器械按照风险程度实行分类管理。
第Ⅰ类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械,境内生产企业需要在所在地市药监局进行备案,境外医疗器械生产企业需要委托境内代理人在CFDA进行备案。
第Ⅱ类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械,境内生产企业需要在所在地省(直辖市)药监局进行注册,境外医疗器械生产企业需要委托境内代理人在CFDA进行注册。
第Ⅲ类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械,无论境内、境外医疗器械生产企业均需要在CFDA进行注册。
2.注册条件
申报主体
拟从事医疗器械生产且在境内销售的境内生产企业
拟出口医疗器械到中国的境外生产企业
拟在中国大陆销售医疗器械产品的港澳台地区的生产企业
注:境外及港澳台生产企业必须委托在中国境内设立的分支机构或指定的代理人进行注册(备案)申报。
医疗器械注册(备案)类型
中国医疗器械按管理类别分为Ⅰ类、Ⅱ类、Ⅲ类医疗器械,具体产品管理类别的归属,以国家食品药品监督管理部门发布的《医疗器械分类规则》、《医疗器械分类目录》以及不定时发布的分类界定通知为主要依据。
按照医疗器械的类别、注册不同阶段等情况,医疗器械的注册可以分为首次注册、注册变更、延续注册三个类型。
|
产品类别 |
注册类型 |
适用范围 |
|
非体外诊断试剂 (无源医疗器械、有源医疗器械) |
备案 |
无论境外如何管理,境内按第Ⅰ类医疗器械管理的产品 |
|
首次注册 |
(1)境外按医疗器械管理的已上市的第Ⅱ、Ⅲ类医疗器械产品首次进入中国市场 (2)境外已上市且不按医疗器械管理而境内需按医疗器械管理的第Ⅱ、Ⅲ类产品首次进入中国市场 |
|
|
注册变更 |
登记事项变更: (1)申请人名称; (2)申请人注册地址 (3)生产地址(文字性改变) (4)代理人名称 (5)代理人注册地址 许可事项变更: (1)产品名称 (2)型号、规格; (3)产品性能结构及组成; (4)产品适用范围。 |
|
|
延续注册 |
(1)到期重新注册 (2)在医疗器械注册证有效期届满6个月前、且有效期届满前12个月内 (3)改变管理类别延续注册 (4)管理类别由高类别调整为低类别的,在有效期内的医疗器械注册证继续有效。如需延续的,申请人应当在医疗器械注册证书有效期届满6个月前、且有效期届满前12个月内,按照改变后的类别到相应的食品药品监督管理部门申请延续注册或办理备案。 (5)管理类别由低类别调整为高类别的,申请人应当按照本办法第六章的规定,在类别调整后6个月内,按照改变后的类别向相应的食品药品监督管理部门申请注册。 |
|
|
体外诊断试剂 |
备案 |
无论境外如何管理,境内按第Ⅰ类医疗器械管理的产品 |
|
首次注册 |
(1)第Ⅱ、Ⅲ类体外诊断试剂产品首次进入中国市场; (2)已上市销售产品基本反应原理改变; (3)已上市销售产品分析灵敏度指标改变,并具有新的临床诊断意义; 其他影响产品性能的重大改变。 |
|
|
注册变更 |
登记事项变更: (1)变更生产企业名称; (2)变更生产企业注册地址; (3)变更注册代理机构; (4)变更代理人。 许可事项变更: (1)变更生产过程中所用抗原、抗体等主要材料; (2)变更检测条件及参考值(或参考范围)等; (3)变更注册产品标准中所设定的项目、指标、试验方法等; (4)变更产品说明书中的内容,如变更或增加包装规格、增加适用机型等; (5)变更产品储存条件和/或产品有效期; (6)增加临床适用范围,如增加临床适应症、增加临床测定用样本类型等; (7)变更生产地址(生产场所的实质性变更); (8)其他可能影响产品安全性、有效性的变更。 |
|
|
延续注册 |
在医疗器械注册证书有效期届满后仍需继续生产、销售的产品应在注册证书有效期届满6个月前、且有效期届满前12个月内提出申请。 |
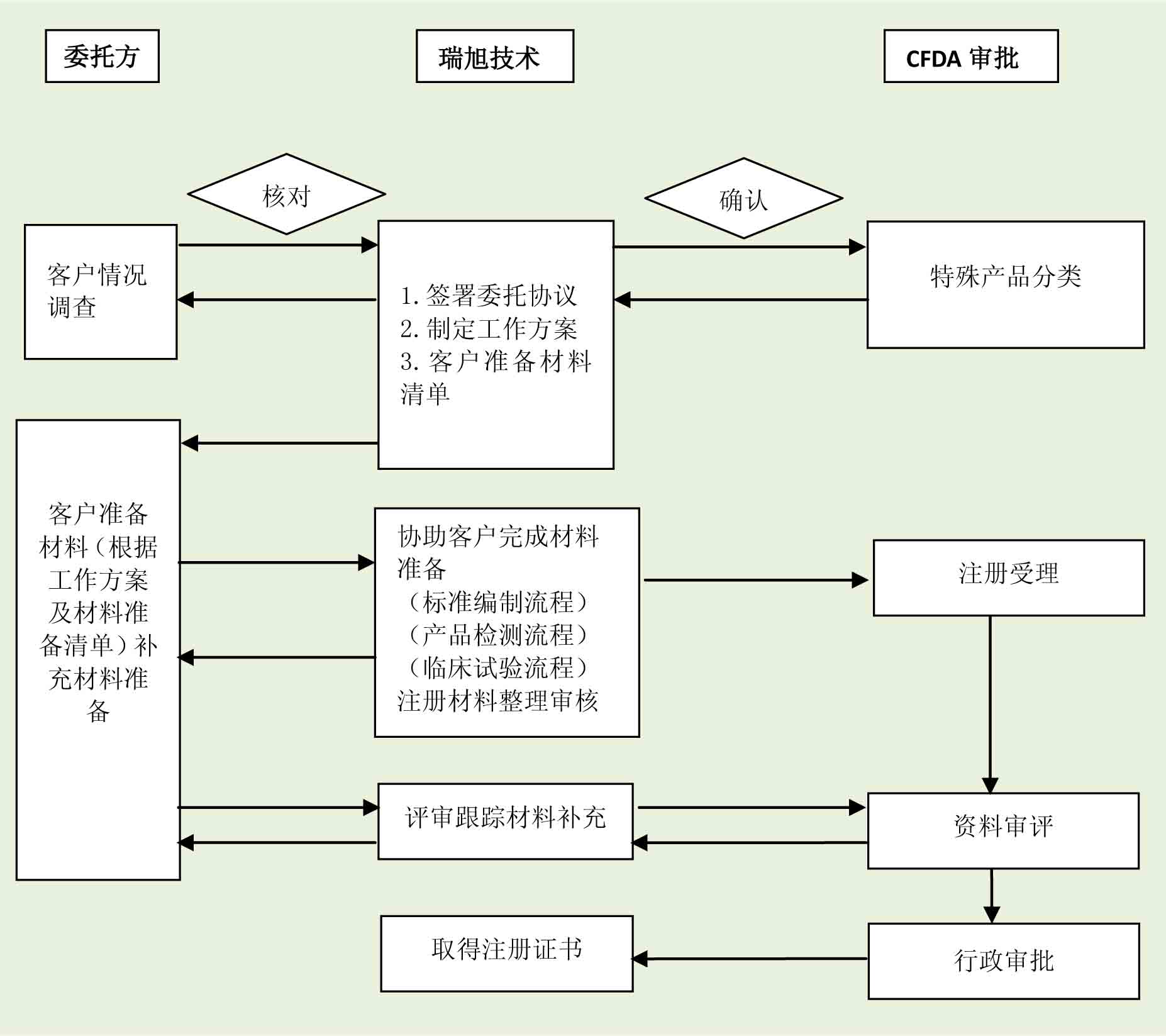
3.注册申请及审批流程
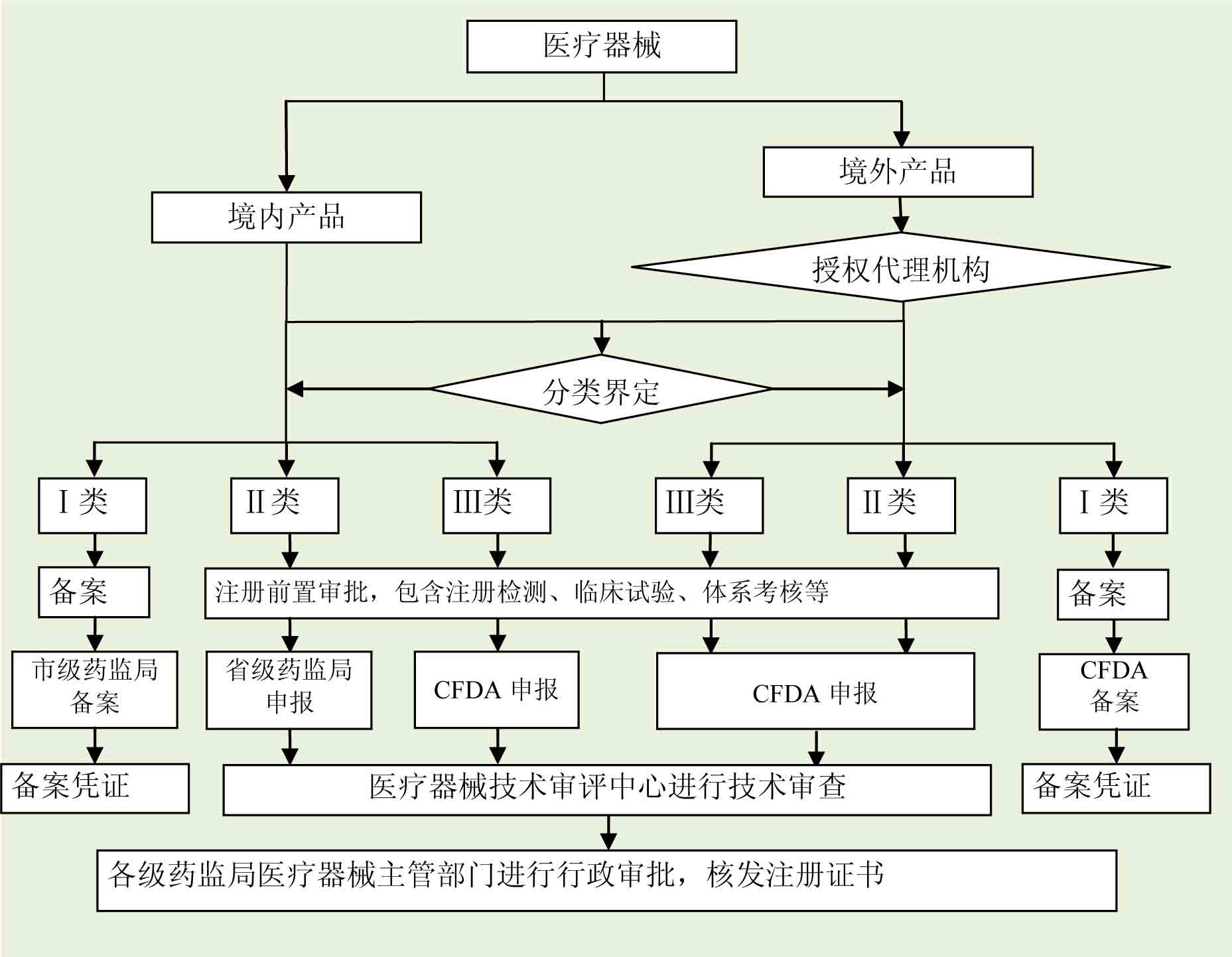
4.医疗器械注册服务流程
提示:
我们医疗器械实验室,也做医疗器械的注册服务。因注册流程可能随时变更,此文相关的文字图片资料也来自网络,仅供学习参考使用。如有详细需求,请来电咨询!
